Structure et fonctionnement de l'ATP synthase (2/2)
-> Structure de l'ATP synthase
2 - Couplage énergétique de l’ATPsynthase.
Mécanisme de changement de liaisons (Modèle de P. Boyer)
Dans ce mécanisme, les trois sites catalytiques dans F1 changent de conformation de manière séquentielle, chacun des sites passant successivement par trois états caractérisés par des constantes d’affinité différentes pour les nucléotides. Chaque site présente respectivement :
- une conformation " relâchée " dans laquelle le site catalytique a une faible affinité (L pour "loose" dans les ouvrages anglo-saxons),
- une conformation " fermée ", dans laquelle le site catalytique a une forte affinité (T pour "tight"),
- une conformation " ouverte " (O pour "open").
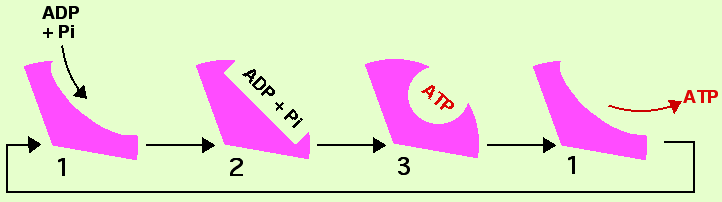
Fonctionnement de l'ATP synthase.
Dans ces diagrammes seules les sous-unités β sont représentées. Chaque sous-unité β est susceptible de passer par trois états successifs :
- 1 (ouvert) - entrée de ADP + Pi
- 2 (ressérré) - charge de ADP + Pi
- 3 (fermé) - formation d'ATP
Retour à l'état 1 et libération de l'ATP formé. Dans ce schéma l'état 1 a été représenté 2 fois, au début pour l'entrée de ADP + Pi, et à la fin pour la libération de l'ATP.
Il est proposé que la forme irrégulière de la "tige", constituée par la sous-unité ϒ solidaire des sous unités c au Fo, provoque en tournant le changement séquentiel de conformation des sous-unités β. En conséquence à chaque instant, les 3 sous-unités catalytiques sont dans un état différent, comme indiqué sur la figure.
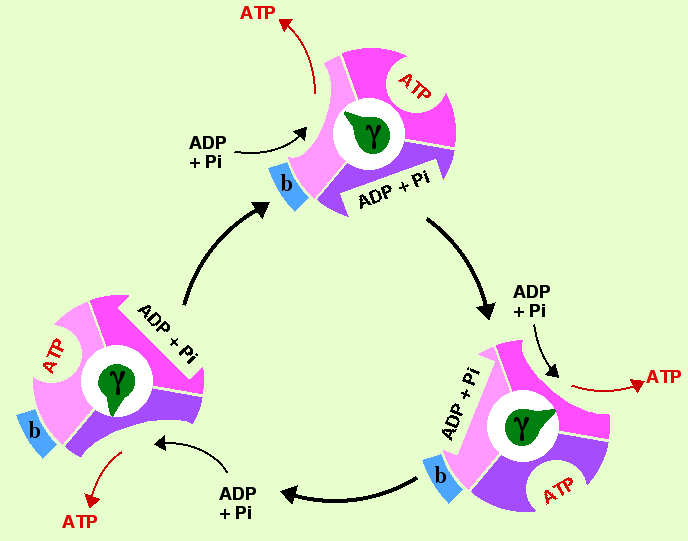
Chaque module du stator (α et β) maintenu en place par b passe successivement par les trois états en fonction de la rotation du rotor (ϒ).
Au cours du cycle catalytique, une molécule d’ATP est liée à un premier site (conformation fermée), tandis qu’une molécule d’ADP et de Pi sont liées sur un second site (configuration lâche) et que le troisième site est vide (conformation ouverte). La rotation d’un tiers de tour (120 °) de la tige ϒ, s’accompagne de la libération d’une molécule d’ATP.
Couplage entre le transport de protons et la synthèse d'ATP
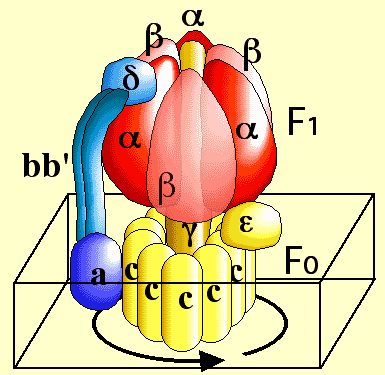
Modèle schématique du fonctionnement de l'ATPsynthase.
Les différentes sous unités constituant le rotor sont représentées en jaune et les différentes unités constituant le stator, en rouge et bleu. Une sous unité β du stator a été rendue légèrement transparente pour permettre de voir la tige ϒ.
L’enzyme fonctionne comme un moteur moléculaire dans lequel le stator est constitué par les sous-unités α et β du F1, les sous unités b, b' et δ et la sous-unité a de Fo. Le rotor est constitué de l’anneau des 10 sous-unités c et de " la tige " interne du F1 (sous-unité ϒ, δ, ε).
La sous-unité a sert à l'entrée des protons qui sont ensuite relayés par la couronne formée par les sous-unités c. La protonation d'une sous-unité c via le demi canal à protons situé du côté du lumen, s'accompagne, de la déprotonation de la sous unité c qui la précède, ce qui fait sortir un proton vers le stroma via le demi canal situé du côté stroma. Le jeu de l'agitation thermique et des interactions électrostatiques entre les sous unités a et c provoque la rotation de la couronne et de la tige ϒ,. Cette rotation est à l'origine de déformations cycliques des sous unités catalytiques, et des changements de conformations et d'affinité qui conduisent à la synthèse de l'ATP.
Ce mécanisme de rotation de la " tige ϒ," par rapport à l’anneau formé par les sous-unités α et β a été démontré par H. Noji, R. Yasuda, M. Yoshida et K. Kinoshita. Le rotor effectue environ 130 révolutions par seconde, chaque rotation complète s’accompagne de la synthèse de trois molécules d’ATP.







