Les protéines d’adhérence de la matrice extracellulaire
Les fibronectines
Les fibronectines sont des glycoprotéines ubiquitaires présentes sous forme soluble dans le plasma sanguin et dans certains liquides biologiques, et sous forme insoluble dans la matrice extracellulaire (sécrétées essentiellement par les fibroblastes). Chez l'être humain, une vingtaine d’isoformes ont été identifiées, résultat de l’épissage alternatif de l’ARN pré-messager issu du gène FIN1 porté par le chromosome 2.
Les fibronectines sont des homodimères de grande taille (440-460kDa). Les deux sous-unités identiques sont reliées par deux ponts disulfures à leur extrémité C-terminale, donnant une forme de V à la molécule. La molécule de fibronectine est composée de domaines rigides reliés par des parties flexibles. Les domaines rigides représentent les sites d’interaction avec les autres composants de la matrice extracellulaire.
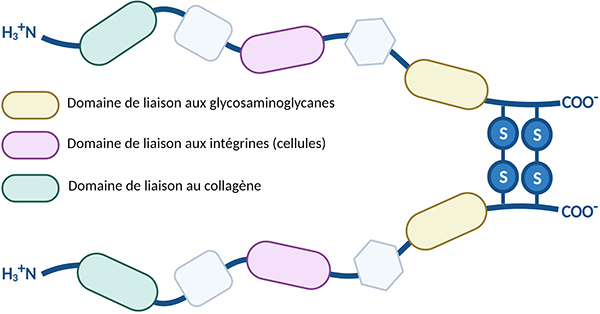
Les fibronectines peuvent également lier les intégrines, récepteurs membranaires cellulaires, qui sont en interaction avec le cytosquelette (microfilaments d’actine) induisant ainsi l’activation de voies de signalisation intracellulaire. Les fibronectines peuvent donc se lier simultanément aux cellules et à d’autres molécules de la matrice extracellulaire, comme le collagène, les glycosaminoglycanes (héparane-sulfate), protéoglycanes ou d’autres molécules de fibronectine.
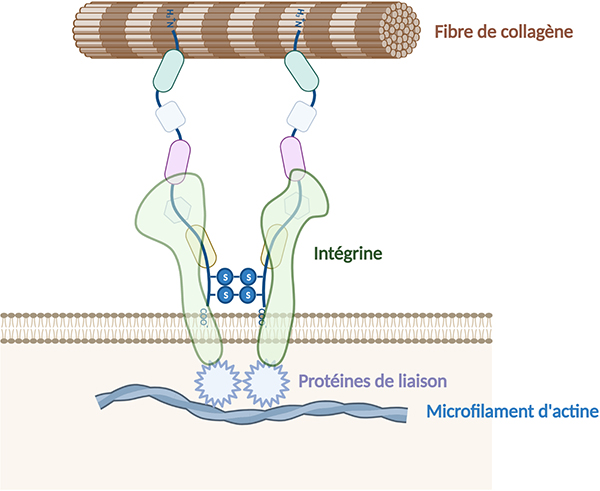
Les fibronectines sont présentes très tôt au cours de développement embryonnaire et jouent alors un rôle dans la migration cellulaire. Dans la matrice extracellulaire, les molécules de fibronectine insolubles s’assemblent pour former des fibrilles à la surface de nombreuses cellules et jouent ainsi un rôle clé dans l’organisation de la matrice extracellulaire. Les fibronectines sont également impliquées dans l’adhésion cellulaire et participent ainsi à divers processus physiologiques (cicatrisation, hémostase, angiogenèse), et pathologiques (inflammation, cancérogenèse).
Les laminines
Les laminines sont une famille de glycoprotéines présentent majoritairement dans les membranes basales, feuillets de protéines de matrice extracellulaire ayant un rôle d’interface entre les tissus conjonctifs et les cellules des tissus épithéliaux ou parenchymateuses, ou associées aux cellules endothéliales de la paroi des vaisseaux sanguins, et aux cellules musculaires.
Les laminines sont des hétérotrimères de grande taille (400-1000 kDa) constituées de l’assemblage de trois chaînes polypeptidiques, α, β et γ. Ces trois sous-unités, codées par trois gènes distincts, sont reliées entre elles par des ponts disulfures donnant à la molécule une forme de croix asymétrique. Il existe 5 isoformes de chaînes α, 3 isoformes de chaînes β et 3 isoformes de chaînes γ. Cette diversité permettant différentes combinaisons, il existe plusieurs isoformes de laminines.
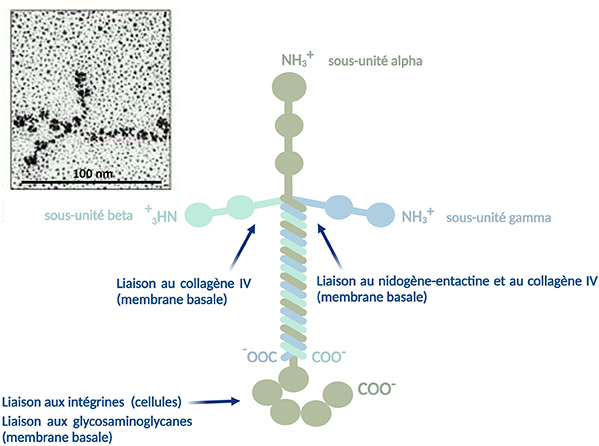
Les laminines possèdent plusieurs sites d’interaction, d’une part avec les cellules via les intégrines, récepteurs des membranes plasmiques des cellules, et d’autre part avec les autres constituants de la matrice extracellulaire (membrane basale) tels que le nidogène-entactine, les protéoglycanes et glycosaminoglycanes. Le nidogène-entactine est une glycoprotéine de la membrane basale qui peut se lier aux fibrilles de collagène IV et aux laminines : ces protéines permettent de réunir laminines et collagène IV.
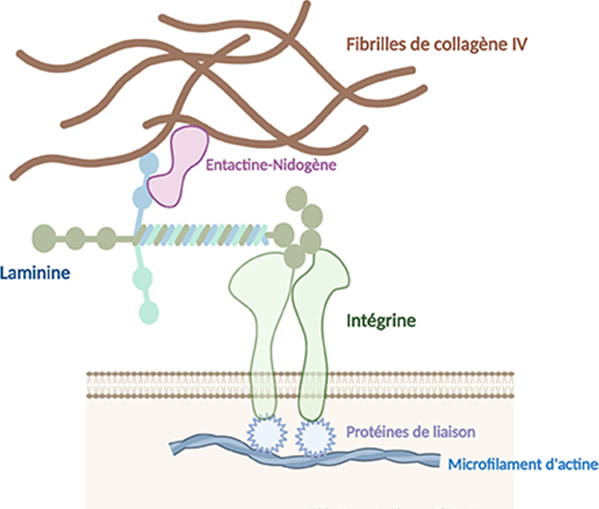
Au cours de l’embryogenèse, les laminines interviennent dans les phénomènes de migrations cellulaires. Les laminines et les fibrilles de collagènes IV forment un réseau en maille qui constitue la charpente de la membrane basale afin de réaliser un maintien structural et fonctionnel des tissus.







